在研究中心法则的同时,人们已注意研究翻译过程所产生的多肽链是如何形成具有完全生物活性的蛋白质的问题。Anfinsen根据著名的核糖核酸酶在变性并还原后可以自发地氧化折叠以恢复天然结构和全部生物活性的实验,提出蛋白质中的氨基酸序列决定其空间结构,即蛋白质的一级结构决定其三维结构的假设。虽然该假设已被广泛地接受,Anfinsen本人也因此而获得诺贝尔奖,但按一定的氨基酸序列排列的多肽链是如何决定蛋白质特定的空间结构的,仍然是分子生物学中有待解决的问题。蛋白质的生物活性不仅依赖于它们的氨基酸序列,而且与其空间构象密切相关。蛋白质的三维构象的完整性即使受到轻微的破坏,也可以导致其生物活性的丧失。因此,只有透彻地了解在蛋白质合成过程中新生肽链如何通过自身内在所含的信息,以及与周围环境(包括多种蛋白质因子)的相互作用,从而形成具有完全生物活性的蛋白质,才能最终阐明遗传信息传递的全过程,才能深入了解蛋白质空间结构的形成与其功能表达之间的关系。一些科学家认为,可能存在一种折叠密码,它决定多肽链氨基酸序列中的一级结构如何向蛋白质特定空间结构的变换。但是,现在看来,这一变换关系相当复杂,恐怕不是像三联密码那样一种简单关系所能概括的。
1、新生肽链的加工
核糖体新合成的肽链——新生肽链必须经过一系列极其复杂的加工和成熟过程,才能成为有活性的蛋白质。这个过程包括多肽链的切除修饰、多肽链的糖基化修饰、多肽的烷基化和去烷基化修饰以及多肽末端的修饰。
有些新生肽链需要剪去中间一段,将两边连接起来,才能成为成熟的功能蛋白。与基因的内含子和外显子类比,被剪切掉的肽链称为“内质”或“蛋白质内含子”,而保留下来的部分称为“外质”或“蛋白质外显子”。内质序列的N-端大约有100个氨基酸,C-端大约有50个氨基酸,共同构成剪接区。这两个剪切区各有一些保守的模式。
2、新生肽链的折叠
新生肽链由一级结构形成三维结构,并成为具有生物活性的功能蛋白的过程称为新生肽链的折叠,这一过程包括了新生肽链的整个成熟过程。蛋白质在行使其生物功能时必须具有特定的三维结构,蛋白质折叠本质上是具有一定氨基酸序列的多肽链逐步折叠形成蛋白质的特定空间结构,从而表现其功能的过程。蛋白质折叠不仅包括新合成的肽链的折叠,也牵涉到诸如蛋白质在细胞中、跨膜运送前后的去折叠和再折叠过程。
新生肽链必须进行折叠,才能形成一定的空间结构,才能发挥其生物活性,成为真正的蛋白质。此外,新合成的多肽链必须定向转运到细胞内特定场所或者被分泌到细胞外,其中,跨膜运送过程可能出现蛋白质的去折叠和再折叠过程,由此蛋白质被运送到特定地点,从而发挥其生物学功能。那么多肽链中的氨基酸序列是按照什么规律决定其折叠成为具有特定构象或空间结构的蛋白质呢,是否在核苷酸密码之外还存在着另一套密码决定着这一过程?
邹承鲁在1988年提出了新生肽链折叠的假说,认为新生肽链的折叠在合成早期业已开始(取决于特定蛋白质分子氨基末端的氨基酸序列),而不是在合成完成后才开始进行;随着肽链的延伸同时进行折叠,又不断进行构象的调整,因此,在肽链延伸过程中形成的结构往往不一定是最终功能蛋白中的结构。这样,新生肽链的合成、延伸、折叠、构象调整,直到最终三维结构的形成,都是一个同时进行的、协调的动态过程。这一新生肽链折叠的假说,将国际上有关新生肽链折叠的长期争论统一起来,强调了新生肽链折叠的结构信息存在于组成多肽链的氨基酸序列中,既考虑到多肽链中特定氨基酸残基的近程相互作用,又重视特定氨基酸残基的远程相互作用在新生肽链折叠中的重要贡献。这一假说的提出,对于最终翻译折叠密码、开辟新生肽链折叠研究的新思路具有重要的指导意义。
3、蛋白质折叠的一般规律
蛋白质折叠问题就是研究蛋白质天然结构是如何形成的,即具有一定氨基酸序列的多肽链如何逐步卷曲形成蛋白质特定空间结构。随着基因工程和蛋白质工程技术的发展,原则上人们已经可以按照需要设计和生产出各种特殊用途的蛋白质。但其中的难题之一就是,基因工程产物往往以没有生物活性的聚合物形式存在,即所谓的“包含体”。如何使包含体重新折叠成具有天然构象的活性蛋白质,这是当前基因工程和蛋白质工程中亟待解决的现实问题。
蛋白质较易受外界因素的影响而丧失活性,这一过程称为蛋白质的变性。高温、高压、溶液中存在变性剂(如酸、碱等),都能引起蛋白质的变性。蛋白质变性时,维系其空间结构的次级键被破坏,原有的空间结构解体,蛋白质肽链调整其结构以适应新环境。在弱变性条件下,蛋白质部分变性,肽链保持一定的结构;在强变性条件下,蛋白质完全变性,伸展成无规的随机肽链。很多变性蛋白质在去除变性因素后,可以自发地恢复其原有的空间结构和生物活性,这一过程称为变性蛋白的重折叠或再折叠。
维系和稳定蛋白质天然结构的作用力有氢键、疏水作用力、范德华力、电荷相互作用力、二硫键和配位键。疏水作用实质上也是一种范德华力,但是,由于它对蛋白质构象稳定有特殊作用,因此常单独考虑。
对某些蛋白质而言,维系蛋白质结构次级键的形成或破坏都是强协调过程。在此情况下,变性或复性是一个“全或无”的过程,又称蛋白质变性或复性的“二态模型”,即只存在两种状态,要么是具有全部结构的天然态,要么是丧失全部空间结构的变性态。对于可逆变性的体系,天然蛋白(N)和变性蛋白(U)之间的平衡反应可表示如下:
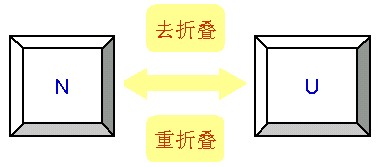
蛋白质肽链在溶液中可能取的构象数是一个天文数字。即使假定每个肽键只能有两种构象(每个肽键的实际构象数目远大于此),那么,由100个氨基酸残基肽链的可能构象也有2100种,经历全部构象的时间要107年以上。但是,一般变性蛋白质的体外重折叠时间只需要几分钟至几小时。这表明:蛋白质的折叠不是一个随机过程,而是通过特定的动力学途径达到天然构象的。
目前,蛋白质结构的测定速度远远低于核酸序列的测定速度,蛋白质结构预测已成为生物信息学的一个重要任务。在蛋白质二级结构和三级结构之间,由a-螺旋和b-折叠片组装成紧凑折叠单元,这种“单元”对于蛋白质结构的分类和预测有重要的作用,称为“折叠单元”或“折叠”。尽管蛋白质序列数以百万计,但是折叠的种类却极为有限,很可能不超过1000种。另一方面,蛋白质的氨基酸序列中含有一些在进化过程中最为保守的单元(称为结构域),它们通常可以相对独立地折叠,形成某种特定的局部空间结构或折叠单元。序列相同的结构域对应相同的折叠单元。蛋白质折叠具有很强的规律性,这意味着可以进行蛋白质结构预测。
4、帮助新生肽链折叠的生物大分子
现在认识到的帮助新生肽链折叠的蛋白质可以分为两大类:一类是分子伴侣(molecular chaperone),另一类则是催化同折叠过程直接相关的化学反应的酶,现在又称为“折叠酶(foldase)”。
分子伴侣是一类相互之间没有关系的蛋白质,它们的功能是帮助含多肽结构的其他物质在体内进行正确的、非共价的组装,但在组装完成后,分子伴侣不作为具有正常生物功能的结构的组成部分。分子伴侣是从功能上定义的,凡是具有这种功能的蛋白质都是分子伴侣,它们的结构可以完全不同,甚至可以是完全不同的蛋白质。与分子伴侣不同,已确定为帮助蛋白质折叠的酶目前只有两种:一种是蛋白质二硫键异构酶,另一种是肽基脯氨酰顺反异构酶。
5、蛋白质构象病问题
与蛋白质折叠有关而且是近几年比较引人注意的是‘构象病’假说的提出。生物医学研究表明蛋白质空间构象发生异常变化会引起疾病发生,形成了蛋白质构象病这一新的病理学概念。一般讲,引起构象病的蛋白质分子与正常蛋白质同时存在于机体内,至少部分蛋白质具有正常折叠的空间构象,并以正常形态释放。当蛋白质构象异常变化时可导致其生物功能丧失,或者引起其后发生的蛋白质聚集与沉积,使组织结构出现病理性改变。


