DNA测序已经为科学家提供了丰富的关于生物系统的信息,不过迄今为止的研究大多集中在对基因组DNA序列和重亚硫酸盐处理后的碱基序列进行比较,分析四种标准碱基和5-甲基胞嘧啶。研究显示核苷酸的许多其他化学修饰也控制着基本生命功能,能影响病原体毒力,并与多种疾病相关。而这些修饰不能通过传统测序方法进行检测。在此背景下,本综述着重介绍了一些新兴的具有直接检测多种DNA碱基修饰类型潜力的单分子测序技术,文章发表在Current Opinion in Structural Biology杂志上。
简介
基因组和转录组的碱基排列决定了所有生物的遗传蓝图和细胞特征,因此核酸测序是研究生物系统最重要的技术之一。二十世纪六十年代末期科学家实现了在群体中对同一DNA分子的4种标准碱基序列进行解码,并且通过Sanger测序发展了一种高通量的自动化技术。随后,第二代测序技术以更低的成本提供了更高的DNA测序通量,尽管该技术以牺牲读长为代价。最近新兴的单分子测序方法,有望为科学家提供极长的DNA测序读段,更快的测序速度,更少的测序前处理步骤,和更强的分析复杂异构DNA混合物的能力。
DNA除了携带基本遗传信息以外,还含有表观遗传学修饰信息。表观遗传修饰现象出现在包括病毒和噬菌体的几乎所有生物体内。这种修饰随着空间(生物体不同组织和细胞类型)和时间(生物体生命周期的不同阶段)的不同而变化,大大扩展了DNA的结构复杂性和信息含量。在高等真核生物中,最常见的表观遗传标记是5-甲基胞嘧啶(5- mC),5- mC 是DNA 复制后DNA甲基转移酶催化产生的。5-mC能影响基因表达、基因组印迹、转座因子抑制和X染色体失活,是生长和发育所必须的,并且涉及多种疾病(包括自闭症和结肠癌)。5-mC测序通常要经重亚硫酸盐的化学处理,将所有胞嘧啶残基转化为尿嘧啶只留下5-mC不变,随后对DNA产物进行扩增将尿嘧啶转化为胸腺嘧啶T。已有多篇文章对该方法和其他基于芯片的非测序方法进行了综述。也有文献对不同重亚硫酸盐方法的优劣进行了详细比较。
虽然针对基因组中4种标准碱基以及5-mC(通过重亚硫酸盐测序)的测序技术不断进步,在速度和效率上不断增加,成效显著,但是对DNA其他重要化学修饰形式进行测序检测的方法却发展得格外缓慢。在此背景下,我们总结了现有的DNA化学修饰知识,回顾了获得这些信息的方法技术,并着重强调了能检测DNA碱基修饰的新兴测序方法。
目前的DNA修饰谱
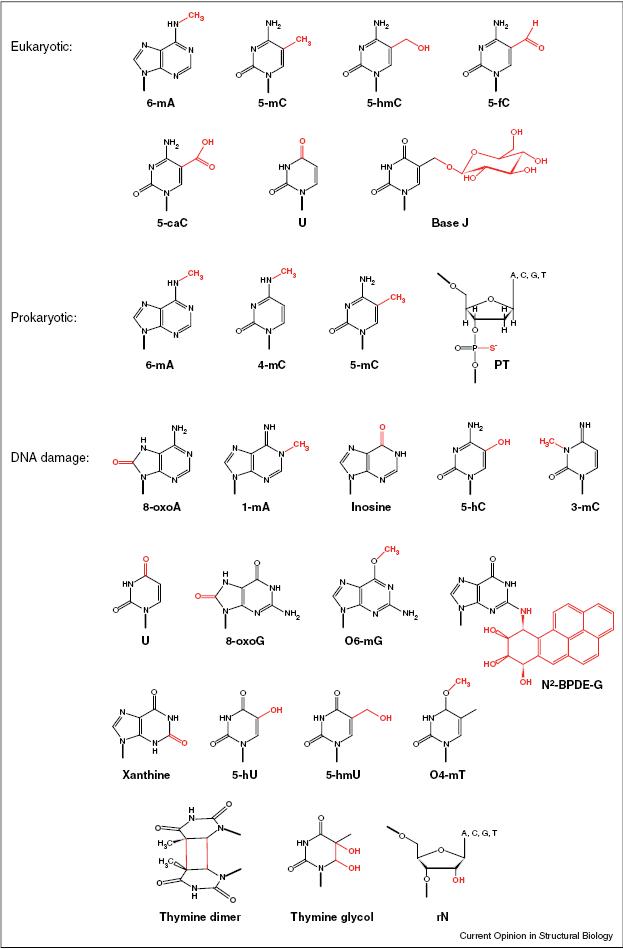
图1:DNA修饰谱,化学键修饰用红色表示。缩写对应:6-mA:N6-甲基腺嘌呤;5-mC:5-甲基胞嘧啶;5-hmC:5-羟甲基胞嘧啶;5-fC:5-甲酰胞嘧啶;5-caC:5-羧基胞嘧啶;U:尿嘧啶; base J:b-D-吡喃葡萄糖氧甲基尿嘧啶;4-mC:4-甲基胞嘧啶;PT:硫代磷酸核苷酸;8-oxoA:8-氧桥腺嘌呤;1-mA:1-甲基腺嘌呤;5-hC:5-羟基胞嘧啶;3-mC: 3-甲基胞嘧啶;8-oxoG: 8-氧桥鸟嘌呤;O6-mG:O6-甲基鸟嘌呤;N2-BPDE-G:二羟环氧苯并芘;5-hU:5-羟基尿嘧啶;5- hmU:5-羟甲基尿嘧啶;O4-mT:O4-甲基胸腺嘧啶;rN:核糖核苷酸
DNA有很多种重要的功能性修饰(图1)。除了5-mC以外,在多种哺乳动物细胞中还检测到了5- mC被Tet酶家族氧化形成的5-羟甲基胞嘧啶 (5-hmC),且5-hmC与胚胎干细胞分化、细胞发育和致癌作用相关。重亚硫酸盐处理方法能检测5-hmC,但不能将其与5-mC区分开。最近在小鼠胚胎干细胞和器官中发现了5-甲酰胞嘧啶 (5- fC),和5-羧基胞嘧啶 (5-caC),这使胞嘧啶的化学修饰形态总数增加为4种,并且引发了人们对是否还存在其他胞嘧啶表观遗传学形态的兴趣。另有研究发现在原生生物、植物和蚊子中存在N6-甲基腺嘌呤(6-mA),有间接证据显示6-mA在哺乳动物中也可能存在。研究人员在特定细胞类型中发现了一些影响特定功能的碱基修饰,如尿嘧啶在先天免疫和适应性免疫中起重要作用,β-D-吡喃葡萄糖氧甲基尿嘧啶(base J)在某些寄生原生动物(如锥虫)中影响基因调控和端粒功能,核糖核苷在酵母细胞周期中印记酵母交配型转换。
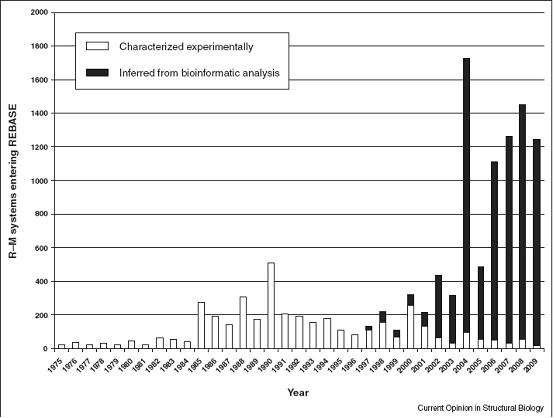
DNA修饰在原核生物中也广泛存在。细菌的已知表观遗传学修饰大多数是限制性内切酶目标序列的甲基化,作为细菌DNA抵御病原体入侵的识别标志。这种限制修饰系统的三种最普遍的碱基修饰是,4-甲基胞嘧啶 (4-mC), 5-mC和6-mA,但也存在其他类型的修饰如硫替代磷酸盐的非桥接氧形成的硫代磷酸修饰。最近几年,研究人员发现的限制修饰系统数量增长的很快(图2)。DNA腺嘌呤甲基转移酶(Dam)形成的6-mA,能调控细胞周期和DNA复制、复制后错配修复、基因表达调控、相变转换phase variation switching和致病性等基本细胞功能。在E. coli中DNA胞嘧啶甲基转移酶(Dcm)催化的5-mC会降低稳定期核糖体蛋白基因的表达。
除了酶促反应介导的有益碱基修饰,DNA损伤也能造成DNA改变。DNA在内源和外源因素造成的持续压力下,碱基的化学稳定性有限,在氧化、烷基化、辐射损伤和水解等不同类型损伤的情况下,DNA容易受到化学修饰。这些DNA损伤造成的DNA碱基修饰在生物体内广泛存在,并对生理状态和疾病表现有重要影响。例如,氧化损伤的产物,如8-羰基腺嘌呤和8-羟基鸟嘌呤(这两种氧化产物在线粒体中尤为广泛存在)与衰老和阿尔茨海默症、帕金森症等神经退行性疾病相关。有害的烷基转移(如1-甲基腺嘌呤、3-甲基胞嘧啶、O6-甲基鸟嘌呤、或O4-甲基胸腺嘧啶)与胶质瘤和结肠癌有关,不过也能应用于化疗中摧毁癌细胞DNA。吸烟、工业化学物或紫外照射等环境因素能导致形成二羟环氧苯并芘(BPDE)和嘧啶二聚体等大化合物,诱发肺癌和皮肤癌。电离辐射也能造成DNA碱基损伤(如5-羟基胞嘧啶、 5-羟尿嘧啶、5-羟基胸腺嘧啶或胸腺嘧啶乙二醇),通过有害自由基生成的直接或间接影响,导致慢性炎症、前列腺癌、乳腺癌和结肠癌。尿嘧啶、黄嘌呤、肌苷和胸腺嘧啶(通过5-mC脱氨基)等的脱氨基产物,具有致突变作用并且能导致多种癌症。基因组DNA在复制过程中整合入核糖核苷酸的损伤类型在酵母中高达0.1%,并与基因组不稳定性有关。
5-mC以外的碱基修饰检测技术大多局限于大型研究方法,如色谱分析、质谱分析、电化学方法、放射性标记和免疫化学分析,或者对限制性内切酶敏感。这些方法一般缺乏确定碱基修饰确切位点和链特异性所必须的分辨率。因此急需能直接检测碱基修饰的测序方法。
图2:限制修饰(R-M)系统进入REBASE数据库的历史,白色柱表示生化或遗传学鉴定的系统,而黑色柱显示生物信息学序列分析推测的潜在R-M系统。编自参考资料。
单分子实时DNA测序
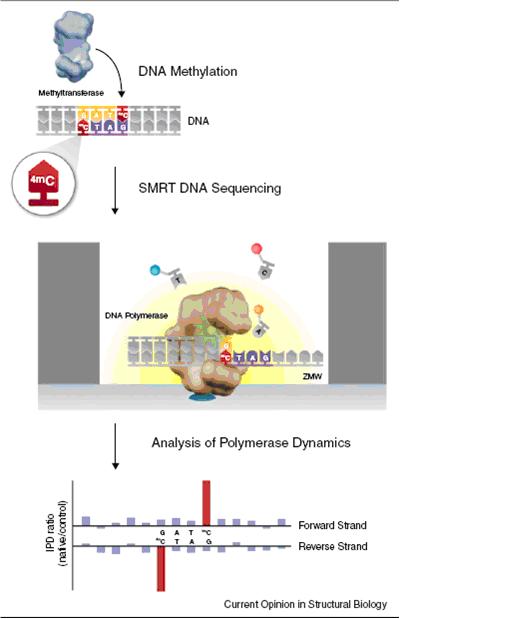
Pacific Biosciences商业化的单分子实时(SMRT1)DNA测序技术是目前唯一市面商品化的单分子测序系统,通过持续监视DNA聚合酶活性进行测序。该技术应用末端带有荧光标记的核苷酸,能实现DNA的连续合成,不再需要washing和gating步骤。作为测序过程的一部分,详细的DNA合成动态以一列荧光脉冲的形式被记录下来。研究者发现聚合酶的动力学会受到DNA模板中修饰碱基的影响。将天然DNA与无修饰的对照模板进行比较,以聚合酶活性部位保持核苷酸结合的时间(脉冲宽度, PW)和核苷酸成功结合状态间的时间间隔(脉冲间隔时间, IPD)作为主要指标,可以检测含碱基修饰的模板是否改变了聚合酶的动力学特征。IPD可能受到两种因素的影响:(i)新结合核苷酸的亲和力改变,或者(ii)标记核苷酸编入引起的DNA移位速度改变。因素(i)对酶构象改变率的影响,和因素(ii)对核苷酸编入循环的催化率的影响都会导致PW的改变,模板中的碱基修饰会扭曲活性位点的构象。由于SMRT测序实时监测每个核苷酸的编入情况,上述影响都能被该技术捕捉到。这种技术对于5-mC等较小化学修饰引起的微小变化也很敏感。
SMRT测序能对天然未扩增的DNA进行测序,可以直接检测DNA碱基修饰。由于SMRT测序的标准模板制备会形成一个闭合环状DNA分子,能对同一个碱基修饰进行多次研究,增加了检测的统计学效力。该技术还能在同一测序读段中对DNA分子的两条链进行测序,直接分析指定位点的正反义链修饰间可能存在的关系。(例如,CpG位点的完全甲基化)
在应用SMRT测序直接检测了5-mC, 5-hmC 和6-mA之后,这项技术随后被应用于三个领域。首先是结合5- hmC特异性富集方法和SMRT测序对5-hmC进行选择性标记和测序。富集方案的一部分是为5-hmC添加化学集团,增强动力学信号,在单DNA分子水平上对5-hmC 的修饰位点和修饰的链特异性进行检测。该方法在合成DNA样品和小鼠胚胎干细胞DNA样品中都得到了成功应用。
随后科学家成功应用SMRT测序确定了16种甲基转移酶的识别序列,包括了全部三种普遍存在的原核表观遗传修饰形4-mC, 5-mC和6-mA,还包括了此前未知序列特异性的三种甲基转移酶(图3)。对于特定甲基转移酶(包括E. coli的Dam甲基转移酶),研究观察到了出人意料的混乱,它们使与源序列相近但并不完全相同的位点甲基化。
SMRT测序还被应用于描绘DNA损伤产物的动力学特征,包括8-羰基鸟嘌呤、8-羰基腺嘌呤, O6-甲基鸟嘌呤、1-甲基腺嘌呤、O4-甲基胸腺嘧啶、5-羟基胞嘧啶、5-羟基尿嘧啶, 5羟甲基尿嘧啶和胸腺嘧啶二聚体。研究显示该技术能方便的对这些碱基修饰的位点和链特异性进行检测。研究者在合成模板中对上述DNA碱基修饰生成的独特动力学特征进行了研究,但该技术还未被用于在生物学样本中检测受损DNA碱基。
上述动力学影响并不限于只影响有化学修饰的核苷酸,而是影响了相关修饰核苷酸周围的区域,即修饰位点约前三个核苷酸和后七个核苷酸。该区域的动力学信号量级依赖于碱基修饰的化学类型和序列本身。这些动力学影响会使聚合酶与DNA模板和初生双链DNA的结合扩大11个碱基。有文献描述了在发生编入错误时,错配通过DNA长程扭曲被传送回酶活性位点的现象。与此相似的是,扩展的DNA结合区域的碱基修饰会引起DNA构象扭曲,影响聚合酶活性位点的核苷酸编入动力学,造成额外信号,形成指定DNA碱基修饰的独特动力学特征。特异性DNA–protein互作和邻近序列效应还有待更详细的分析,而这些动力学特征已可用于区分不同的碱基化学修饰。对上述影响的广泛分析被用于区分具有相似特征的碱基修饰(如6-mA and 1-mA),以及分辨位置非常接近的碱基修饰。对于那些动力学影响相对较小的修饰(如5-mC),目前推荐使用更高的测序覆盖度倍数进行置信度评价,并且需要开发能生成更强动力学信号的酶。
图3:SMRT测序鉴定DNA甲基化。通过SMRT测序分析聚合酶动力学,对天然DNA样品和无修饰的对照序列进行比较,检测甲基转移酶催化的碱基甲基化。如图显示甲基转移酶M.EsaLHCI催化DNA序列的50-GATC-30处4-mC甲基化。
纳米孔单分子测序
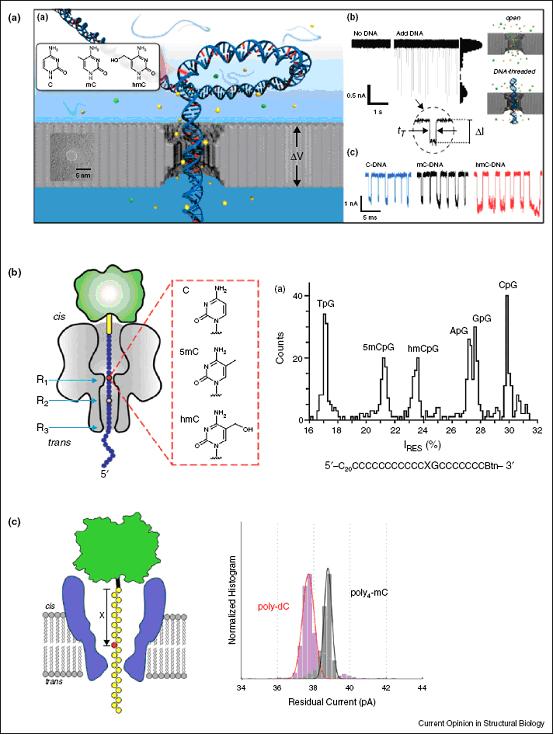
在纳米孔单分子测序技术中,相关纳米孔直径只允许严格线性序列的单链DNA通过。纳米孔可以是生物源的,如a-溶血素 (aHL) 或MspA蛋白等膜蛋白复合体。也可以由固体材料合成,如氮化硅、氧化铝、多层石墨烯三明治、单层石墨烯或者碳纳米管。纳米孔包括一个能区分不同碱基的检测区域,在碱基穿过纳米孔时生成相应的短暂信号。随后对不同类型的信号进行评估,包括穿过纳米孔的电流阻塞、跨越纳米孔的隧道电流或者电容改变。
研究显示,该技术能通过电流信号在固定于aHL 纳米孔、MspA孔或穿过氮化硅纳米孔的单链DNA片段中对5-mC和5-hmC进行区分(图4)。该技术成功的关键是对DNA穿孔转运的精确控制,在一些研究项目中科学家利用了酶活性来辅助这一技术,如将核酸外切酶或聚合酶放置在纳米孔入口附近。研究显示,使用共价结合了环糊精分子作为检测读取头部的aHL纳米孔,结合核酸外切酶,通过检测残基的纳米孔电流,能够从自由核苷酸磷酸盐单体形式的四种标准碱基中区分5-mC。有文章显示,该技术结合聚合酶,通过检测DNA复制时模板链穿过纳米孔产生的电流阻塞差异,能实时监测DNA聚合酶连续添加核苷酸的过程。由于该技术是基于对DNA聚合酶的连续活性进行单分子实时监测来进行测序,可想而知也可以通过与SMRT测序分析聚合酶动力学相同的方式对碱基修饰进行检测。为了通过单独监测每个纳米孔电信号获得大量多重分析信息,有文章报道了一种可供选择的方案,能对多个纳米孔进行平行的光学读取,但这需要将目标DNA序列的每一个核苷酸进行转化标记上分子信标,而这种样品制备方法难以应用于检测碱基修饰。
图4:纳米孔测序检测5-mC和5-hmC。通过残基孔电流差异检测到了胞嘧啶的修饰。
显微镜单分子测序
有研究应用先进的电子显微镜技术以单碱基的空间分辨率,对DNA模板分子的遗传和表观遗传学信息进行直接读取。包括利用透射电镜(TEM)直接对能唯一地区分不同碱基的原子进行化学检测。以及用碘和溴等化合物对碱基进行化学标记,以增强检测能力和对比度。可以想见在未来,能利用显微镜直接成像或碱基修饰特异性化学转化技术对特定碱基修饰进行检测,如用含可检测原子的葡萄糖标记5-hmC或带可检测链的叠氮葡萄糖标记(类似方法见)。
显微镜方法成功的一个先决条件是将各DNA分子结合到可靠的基底上。近来有研究将DNA分子转印到单层石墨烯上(被认为是高分辨率电镜的最佳基底),通过高分辨率电子束照射和电子能量损失谱分析,成功应用了使这项技术。这种方法随后被用于检测5-mC在DNA分子上的分布,该研究依据荧光标记的methyl-CpG结合多肽的结合情况,能对不同甲基化水平的DNA分子进行比较,该方法目前只用于宽场荧光检测。该文章显示该方法也能适用于超高分辨率光学显微镜或电子显微镜技术,以增强空间分辨率。
还有研究报道了使用扫描隧道显微镜(STM)对单链DNA分子进行成像,通过分析STM 原子针尖、碱基和导电表面之间隧道电流的差异检测四种碱基。科学家利用该技术得到了已知序列的单链DNA分子中的鸟嘌呤“电子指纹”。未来,可能通过这种方法得到其他碱基修饰的电子指纹。
RNA直接测序
人们在RNA分子中发现了更大量的碱基修饰。这些修饰是决定重要代谢过程的结构和调控所必须的,且与疾病发展相关。曾今由于缺少常规高通量的RNA直接测序技术,要在测序水平上进行RNA修饰研究很困难。而繁重非测序分析方法往往缺乏足够的分辨率,大大限制了RNA碱基修饰研究。重亚硫酸盐处理也被用于在RNA研究中检测RNA5-mC甲基化模式。在cDNA合成过程中,特定RNA碱基修饰会引起互补cDNA链的碱基改变(如:腺嘌呤-肌苷修饰,肌苷在体外反转录中被识别为鸟嘌呤),因此能通过比较cDNA序列和同源基因组序列就能对RNA碱基修饰进行推断。
有研究描述了基于Helicos方法的RNA直接测序short-read技术,但与DNA测序情况类似,该方法难以应用于检测RNA碱基修饰。在最近的文章中,通过用一个逆转录酶代替DNA聚合酶,研究人员应用SMRT测序直接读取RNA模板信息,在合成RNA模板和转染了报告系统的细胞RNA中成功检测了6-mA。
结论
DNA测序对我们的生物学知识进行了革新,从根本上改变了生物学的研究方式。通过强大的计算方法将广泛且高效的DNA和cDNA测序,与蛋白质组学、生物分子动力学和大量其他表型信息结合起来,能使生物学研究形成彻底转变,从而改善人类健康、提高食品和能源供给和加强环境保护。然而迄今为止,测序研究还主要集中在四种标准碱基和5-mC上,而这些研究所提供的DNA结构信息明显不足。研究显示大量核苷酸修饰在多种重要生物学过程中起着决定性作用,包括基因表达、免疫力、疾病和致病性。此外,根据近期新碱基修饰的发现速率推断,很可能功能性相关的DNA化学修饰还没有完全被发现。
因此就需要加快开发高通量的自动化测序新技术,以分析A, C, G, T和 5-mC以外的DNA信息,揭示DNA的全部结构和功能复杂性。在一些新兴测序方法的帮助下,我们将步入揭示广泛表观遗传学信息的测序革命下一阶段。
参考文献:
- Tyson A Clark, Kristi E Spittle, Stephen W Turner and Jonas Korlach. Direct Detection and Sequencing of Damaged DNA Bases. Genome Integrity 2011, 2:10
- Tyson A. Clark, Iain A. Murray, Richard D. Morgan,Andrey O. Kislyuk,Kristi E. Spittle,Matthew Boitano, Alexey Fomenkov, Richard J. Roberts,* and Jonas Korlach1. Characterization of DNA methyltransferase specificities using single-molecule, real-time DNA sequencing. Nucl. Acids Res. (2011) doi: 10.1093/nar/gkr1146
- Benjamin A Flusberg , Dale R Webster , Jessica H Lee , Kevin J Travers , Eric C Olivares , Tyson A Clark , Jonas Korlach & Stephen W Turner. Direct detection of DNA methylation during single-molecule, real-time sequencing. Nature Methods 7, 461–465 (1 June 2010) | doi:10.1038/nmeth.1459.
本文内容由以下内容整合:
http://www.ebiotrade.com/newsf/2012-6/2012619140840497.htm
http://www.ebiotrade.com/newsf/2012-6/2012619153046149.htm
http://www.ebiotrade.com/newsf/2012-6/2012619154410452.htm