一:安装并加装该R包
安装就用source(“http://bioconductor.org/biocLite.R”) ;biocLite(“DESeq”)即可,如果安装失败,就需要自己下载源码包,然后安装R模块。
二.所需要数据
它的说明书指定了我们一个数据
- source(“http://bioconductor.org/biocLite.R”) ;
- biocLite(“pasilla”)
安装了pasilla这个包之后,在这个包的安装目录就可以找到一个表格文件,就是我们的DESeq需要的文件。
C:\Program Files\R\R-3.2.0\library\pasilla\extdata\pasilla_gene_counts.tsv
说明书原话是这样的
The table cell in the i-th row and the j-th column of the table tells how many reads have been mapped to gene i in sample j.
一般我们需要用htseq-count这个程序对我们的每个样本的sam文件做处理计数,并合并这样的数据
下面这个是示例数据,第一列是基因ID号,后面的每一列都是一个样本。
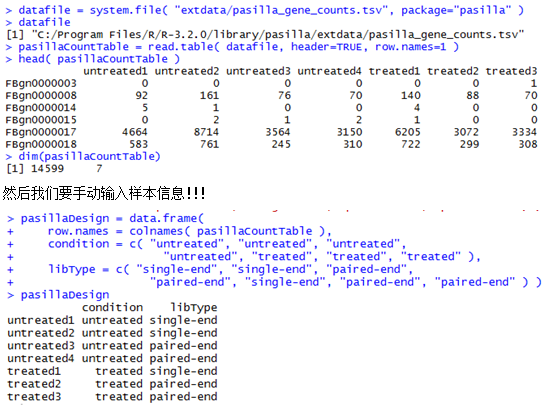
- de = newCountDataSet( pasillaCountTable, condition ) #根据我们的样本因子把基因计数表格读入成一个cds对象,这个newCountDataSet函数就是为了构建对象!
- 对我们构建好的de对象就可以直接开始找差异啦!非常简单的几步即可
- de=estimateSizeFactors(de)
- de=estimateDispersions(de)
- res=nbinomTest(de,”K”,”W”) #最重要的就是这个res表格啦!
- uniq=na.omit(res)
- 我这里是对4个样本用htseq计数后的文件来做的,贴出完整代码吧
- library(DESeq)
- #首先读取htseq对bam或者sam比对文件的计数结果
- K1=read.table(“742KO1.count”,row.names=1)
- K2=read.table(“743KO2.count”,row.names=1)
- W1=read.table(“740WT1.count”,row.names=1)
- W2=read.table(“741WT2.count”,row.names=1)
- data=cbind(K1,K2,W1,W2)
- data=data[-c(43630:43634),]
- #把我们的多个样本计数结果合并起来成数据框,列是不同样本,行是不同基因
- colnames(data)=c(“K1″,”K2″,”W1″,”W2″)
- type=rep(c(“K”,”W”),c(2,2))
- #构造成DESeq的对象,并对分组样本进行基因表达量检验
- de=newCountDataSet(data,type)
- de=estimateSizeFactors(de)
- de=estimateDispersions(de)
- res=nbinomTest(de,”K”,”W”)
- #res就是我们的表达量检验结果
- library(org.Mm.eg.db)
- tmp=select(org.Mm.eg.db, keys=res$id, columns=”GO”, keytype=”ENSEMBL”)
- ensembl_go=unlist(tapply(tmp[,2],as.factor(tmp[,1]),function(x) paste(x,collapse =”|”),simplify =F))
- #首先输出所有的计数数据,加上go注释信息
- all_res=res
- res$go=ensembl_go[res$id]
- write.csv(res,file=”all_data.csv”,row.names =F)
- #然后输出有意义的数据,即剔除那些没有检测到表达的基因
- uniq=na.omit(res)
- sort_uniq=uniq[order(uniq$padj),]
- write.csv(sort_uniq,file=”sort_uniq.csv”,row.names =F)
- #然后挑选出padj值小于0.05的差异基因数据来做富集,富集用的YGC的两个包,在我前面的博客已经详细说明了!
- tmp=select(org.Mm.eg.db, keys=sort_uniq[sort_uniq$padj<0.05,1], columns=”ENTREZID”, keytype=”ENSEMBL”)
- diff_ENTREZID=tmp$ENTREZID
- require(DOSE)
- require(clusterProfiler)
- diff_ENTREZID=na.omit(diff_ENTREZID)
- ego
- ekk
- write.csv(summary(ekk),”KEGG-enrich.csv”,row.names =F)
- write.csv(summary(ego),”GO-enrich.csv”,row.names =F)
原文来自:http://www.bio-info-trainee.com/741.html


