大家都知道,这十几年来最流行的差异分析软件就是R的limma包了,但是它以前只支持microarray的表达数据。
考虑到大家都熟悉了它,它又发了一个voom的方法,让它从此支持RNA-seq的count数据啦!大家都知道芯片数据跟RNA-seq数据的本质就是value的分布不一样,所以各种针对RNA-seq的差异分析包也就是提出来一个新的normalization方法而已。而我们limma本身就提出了一个voom的方法来对RNA-seq数据进行normalization
使用这个包也需要三个数据:
- 表达矩阵
- 分组矩阵
- 差异比较矩阵
用法与limma一模一样的,只是多了一个normalization而已。
读取自己的数据
一般我们会自己读取表达矩阵和分组信息,下面是一个例子:
- options(warn=-1)
- suppressMessages(library(DESeq2))
- suppressMessages(library(limma))
- suppressMessages(library(pasilla))
- data(pasillaGenes)
- exprSet=counts(pasillaGenes)
- head(exprSet) ##表达矩阵如下
- ## treated1fb treated2fb treated3fb untreated1fb untreated2fb
- ## FBgn0000003 0 0 1 0 0
- ## FBgn0000008 78 46 43 47 89
- ## FBgn0000014 2 0 0 0 0
- ## FBgn0000015 1 0 1 0 1
- ## FBgn0000017 3187 1672 1859 2445 4615
- ## FBgn0000018 369 150 176 288 383
- ## untreated3fb untreated4fb
- ## FBgn0000003 0 0
- ## FBgn0000008 53 27
- ## FBgn0000014 1 0
- ## FBgn0000015 1 2
- ## FBgn0000017 2063 1711
- ## FBgn0000018 135 174
- group_list=pasillaGenes$condition
- ## [1] treated treated treated untreated untreated untreated untreated
- ## Levels: treated untreated
- ##这是分组信息,7个样本,3个处理的,4个未处理的对照!
另外一个例子是从airway里面得到表达矩阵和分组信息
- library(airway)
- data(airway)
- exprSet=assays(airway)$counts ## 表达矩阵
- group_list=colData(airway)$dex ## 分组信息
第一步:构建分组矩阵
- suppressMessages(library(limma))
- design <- model.matrix(~factor(group_list))
- colnames(design)=levels(factor(group_list))
- rownames(design)=colnames(exprSet)
- design
- ## treated untreated
- ## treated1fb 1 0
- ## treated2fb 1 0
- ## treated3fb 1 0
- ## untreated1fb 1 1
- ## untreated2fb 1 1
- ## untreated3fb 1 1
- ## untreated4fb 1 1
- ## attr(,"assign")
- ## [1] 0 1
- ## attr(,"contrasts")
- ## attr(,"contrasts")$`factor(group_list)`
- ## [1] "contr.treatment"
第二步:根据分组信息和表达矩阵进行normalization
这里构建了一个对象 An object of class “EList”
- v <- voom(exprSet,design,normalize="quantile")
- ## 下面的代码如果你不感兴趣不需要运行,免得误导你
- ## 就是看看normalization前面的数据分布差异
- #png("RAWvsNORM.png")
- exprSet_new=v$E
- par(cex = 0.7)
- n.sample=ncol(exprSet)
- if(n.sample>40) par(cex = 0.5)
- cols <- rainbow(n.sample*1.2)
- par(mfrow=c(2,2))
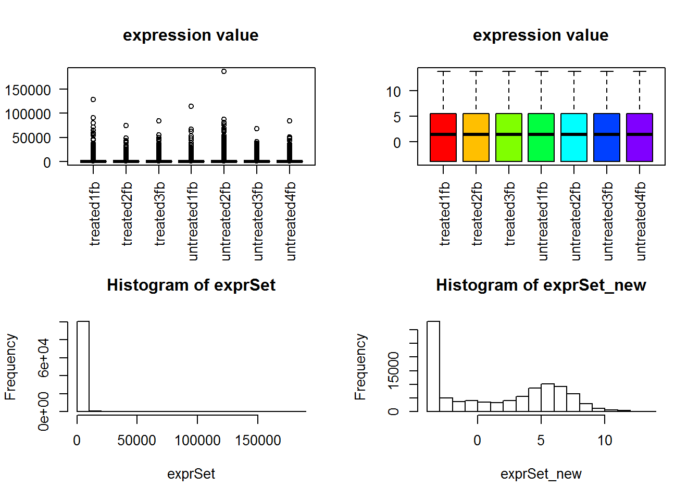
- boxplot(exprSet, col = cols,main="expression value",las=2)
- boxplot(exprSet_new, col = cols,main="expression value",las=2)
- hist(exprSet)
- hist(exprSet_new)
- #dev.off()
可以很明显看到normalization前后数据分布差异非常大!
第三步:做差异分析,提取差异分析结果
这里不需要差异比较矩阵了,因为我的分组矩阵表明样本就分成两组,直接提取coef=2的数据即可
- fit <- lmFit(v,design)
- fit2 <- eBayes(fit)
- tempOutput = topTable(fit2, coef=2, n=Inf)
- DEG_voom = na.omit(tempOutput)
- head(DEG_voom)
- ## logFC AveExpr t P.Value adj.P.Val
- ## FBgn0029167 2.1608689 7.880589 41.19142 5.195806e-08 0.0007518331
- ## FBgn0003137 -0.9560776 8.421903 -29.97211 2.920473e-07 0.0021129620
- ## FBgn0003748 -1.0385933 6.395990 -23.78787 1.020682e-06 0.0049230892
- ## FBgn0035085 2.5190255 5.221183 21.01339 1.993995e-06 0.0058809216
- ## FBgn0050185 -0.4886279 5.487547 -19.95422 2.635106e-06 0.0058809216
- ## FBgn0015568 -1.1040979 3.922438 -19.96954 2.624231e-06 0.0058809216
- ## B
- ## FBgn0029167 9.065020
- ## FBgn0003137 7.800063
- ## FBgn0003748 6.652695
- ## FBgn0035085 5.870585
- ## FBgn0050185 5.734162
- ## FBgn0015568 5.55756
差异分析结果就不解释啦!
原文来自:www.bio-info-trainee.com